研究概要
研究概要
近年、dualエピトープ認識するbispecific antibody(bsAb)が新たな抗体薬として開発されている。Fc部分にIgG4-Fcが多用されるが、IgG4-FcはADCC(抗体依存性細胞傷害性), CDC(補体依存的細胞傷害性)作用などを有さないことから、もっぱら中和能を期待する治療用途に使用されている。“Arm exchange”しヒト体内で生成する2重特異性を有するIgG4は、自己生成するbsAbsと言える。すなわち、IgG4抗体はFc部位の補体結合性や活性型受容体への親和性が低いことにより、CDCやNK細胞などをエフェクター細胞とするADCC作用が低く、中和作用を期待する抗体薬Fc部位として多用されるIgGクラスとなっている。
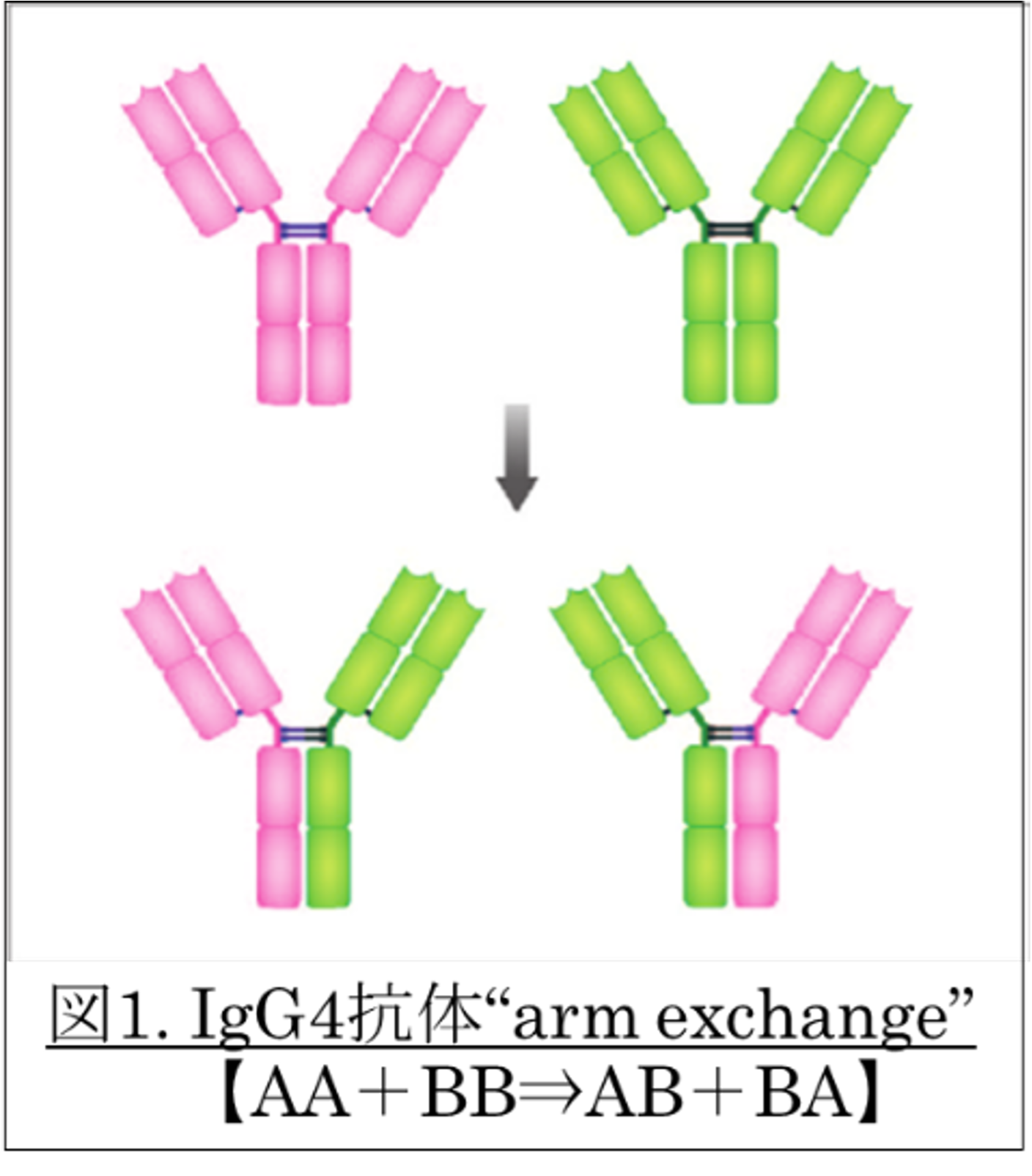
右図には、“arm exchange”を模式図に示した。生体内にて「抗体の高機能化」が、post genome的に不断に、継続されていることとなる。未だに、arm exchangeの頻度などは不明なままである。
ヒトIgG4は医療応用が先行している一方で、生体内生成のIgG4抗体のarm exchangeとその病態関与に正面から取り組んだ研究は少ない。本邦で定められた「IgG4関連疾患/自己免疫疾患」を臨床標的として、IgG4抗体が認識する自己抗原を探索する研究が継続して行われている。さらにアレルギー疾患のアレルゲン免疫療法(AIT)の施行により上昇してくる特異的IgG4抗体は、アレルギー発症に関わるIgE反応を阻害・抑制するとされる。このブロッキングIgG4抗体も、図1のようにarm exchangeを起こし、アレルゲン認識のプロファイルは、より複雑であろうと推察される。
この未解明なIgG4免疫学を、基礎研究に根差しつつ、ヒトに特有の抗体クラスであることを背景として、ヒト疾患とその病態修飾の未解明な課題を真正面にとらえて研究する。もって、当初の研究室設立の目的である、疾患バイオマーカーの同定と治療薬の開発につなげる。
研究内容
1)IgG4抗体の基礎研究
-研究内容は以下のような項目について、IgG4抗体の特徴を深堀りする研究を行っている。伊藤特任准教授が精力的に進めている。
1-1. 患者血中のPB細胞に由来する単一抗体の作出と特性評価
1-2. bsAbs(IgG4抗体)の作出と機能解析
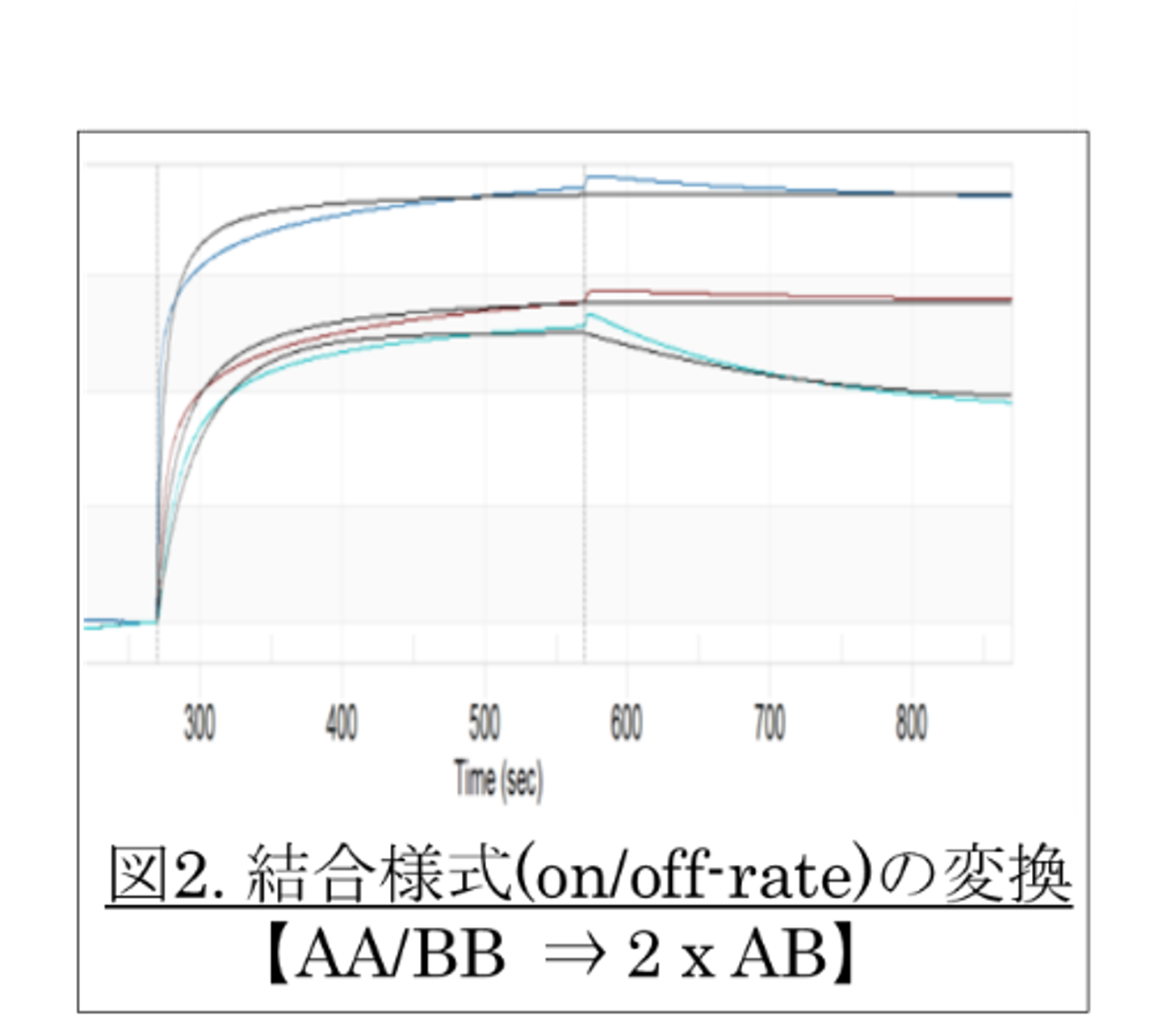
1-3. IgFc-受容体の各タイプへの親和性と機能発現
(図2参照:親和性KDのon-rate/off-rate特徴を解析)
2)IgG4抗体の病態関連性
-上記のように、ヒト体内にて生成するIgG4抗体は多様な機能を有する。以下の3項目を基点として、研究している。
2-1. IgG4-RD / 自己免疫疾患(IgG4-related disease / autoimmune disease)における、新規自己抗原および認識エピトープの探索と同定、並びに疾患関与の解明
IgG4関連疾患は、日本で疾患概念が確立され世界に発信された全身性慢性炎症性疾患である。病因に関して標的分子が明らかでないため、糖質コルチコイド(ステロイド)以外の有効な治療法がないのが現状である。近年、活動期に末梢血中の形質芽球(plasmablast:PB)がオリゴクローナルに増えていることが明らかにされた。これらのクローンは体細胞超突然変異を認めており、なんらかの抗原刺激の結果生じたものと考えられる。IgG4-RDの病因に何らかの自己抗原が関与している可能性が考えられ、これまでに国内外でいくつもの自己抗原候補が同定されてきた。これらには、Prohibitin, Laminin 511-E8, Annexin A11, Galectin-3がある。私達は、オリゴクローナルに増えている抗体に対応する自己抗原を明らかにすること、自己抗体プロファイル、エピトーププロファイルと臨床徴候との関連を検討することを目指している。
自己免疫疾患においても、膜性腎症において主要自己抗原であるPLA2Rに対するエピトーププロファイルが、重症度や予後と関連していたとする報告がある(J Am Soc Nephrol, 2016)。つまり、自己抗原のエピトーププロファイルは疾患に深く関わっている。私たちは、他の自己免疫疾患においても、自己抗体プロファイル、エピトーププロファイルと臨床徴候との関連を検討することを目指している。
2-2. アレルギー疾患における、抗原特異的IgG4抗体の寛容誘導機序の解明
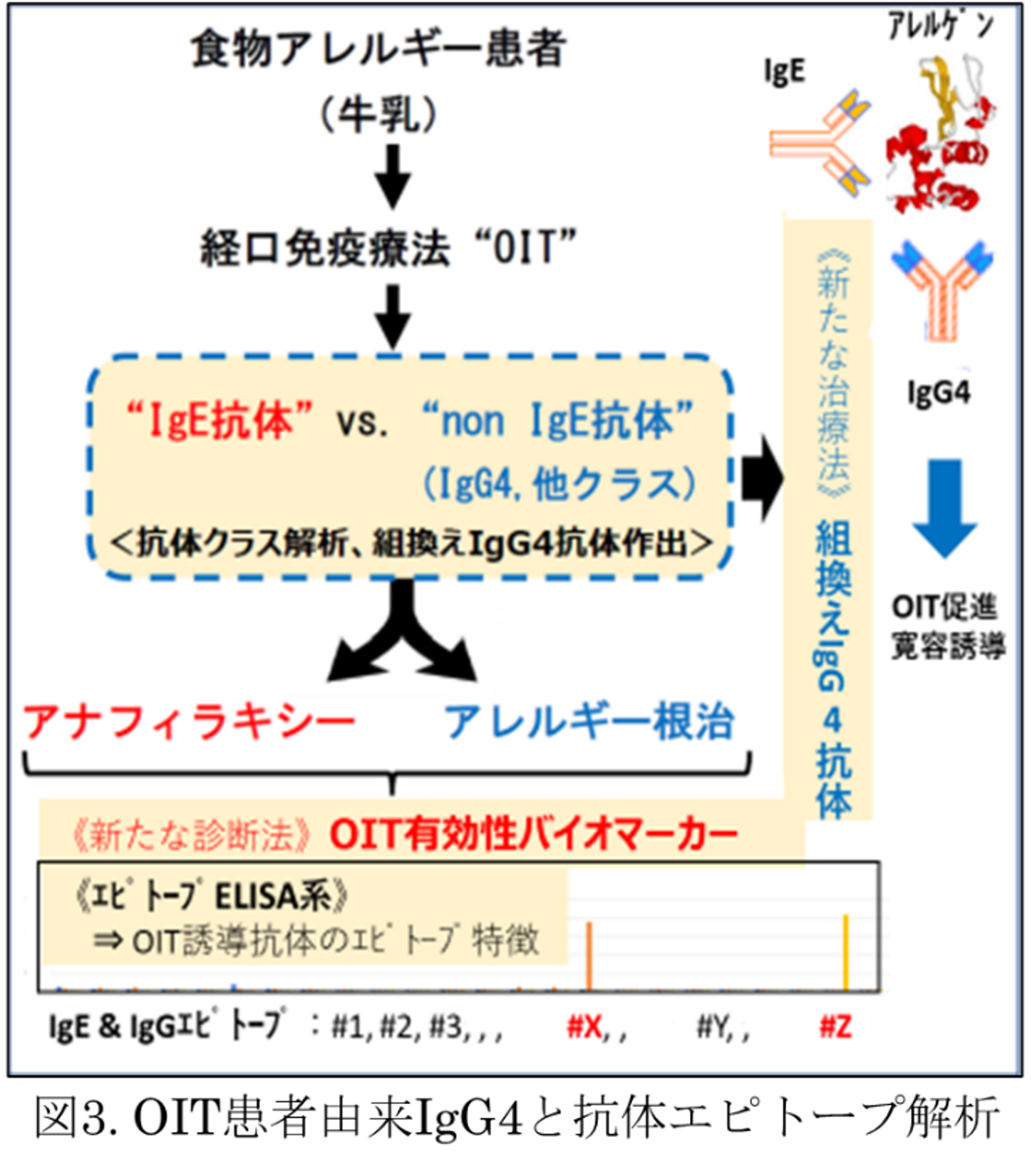
I型アレルギーはアレルゲンを認識するIgE抗体が生成し、再度暴露されたときにアレルゲンを補足したIgEが、FceRsを発現する肥満細胞や好塩基球などエフェクター細胞を活性化し、ヒスタミン等メディエイターや炎症性サイトカインを過剰産生することによって、発症増悪する。ヒトにおいては、アレルゲン食物の経口免疫療法(OIT)や症状が誘発されない量まで原因食物を摂食する食事療法によって、アレルゲン特異的なIgG4抗体が上昇しIgE介在性の反応が阻害・抑制される機序が提唱され、検証されてきた。冒頭に記述したが、ヒトIgG4抗体のマウス相同抗体がないことから、動物モデルを用いては厳密な検証ができない。このように、アレルゲン特異的なIgG4の機能につては、いまだに未解明な部分が多い。
当研究室では、この未解明なIgG4抑制機序について、仮説を設定しそれを検証することで、一般化可能な「アレルゲン特異的に寛容誘導できる機序」を解明しようとしている。そのために、食物アレルギー患者にOITなどを施行した患者由来の、単一B細胞(形質芽球:Plasma Blast/PB)から取得した組換え抗体やマウス由来の抗体をヒトIgG4クラス抗体に組換えた抗体を各種作出して、IgE反応阻害作用やアレルギー抑制機能を解析している(図3および図3右側出口)。これらの研究は、福井大学小児科(大嶋勇成教授)、神戸市医療センター中央市民病院(岡藤郁夫小児科医長)との共同研究である。
2-3. IgG4が認識するエピトープ解析技術の改良と革新
過去に、新規のがん抗原を探索するために、SEREX法(Serological expression cloning法)を用いていた。その標的がん抗原の検証、即ちがん患者血清で陽性で、非がん患者では陰性であることの検証には、がん抗原蛋白を用いたELISA系では非特異的抗体陽性(false positive)が一定頻度で検出される。より精度の良い(false positiveの少ない)評価系・検出系として、“がん抗原のペプチドELISA系”をもちいて検証した。生体内で繰り返し感作されるがん抗原-neoantigen-は、高い頻度で免疫系に認識され、がん抗原特異的な抗体を生成しているのである。
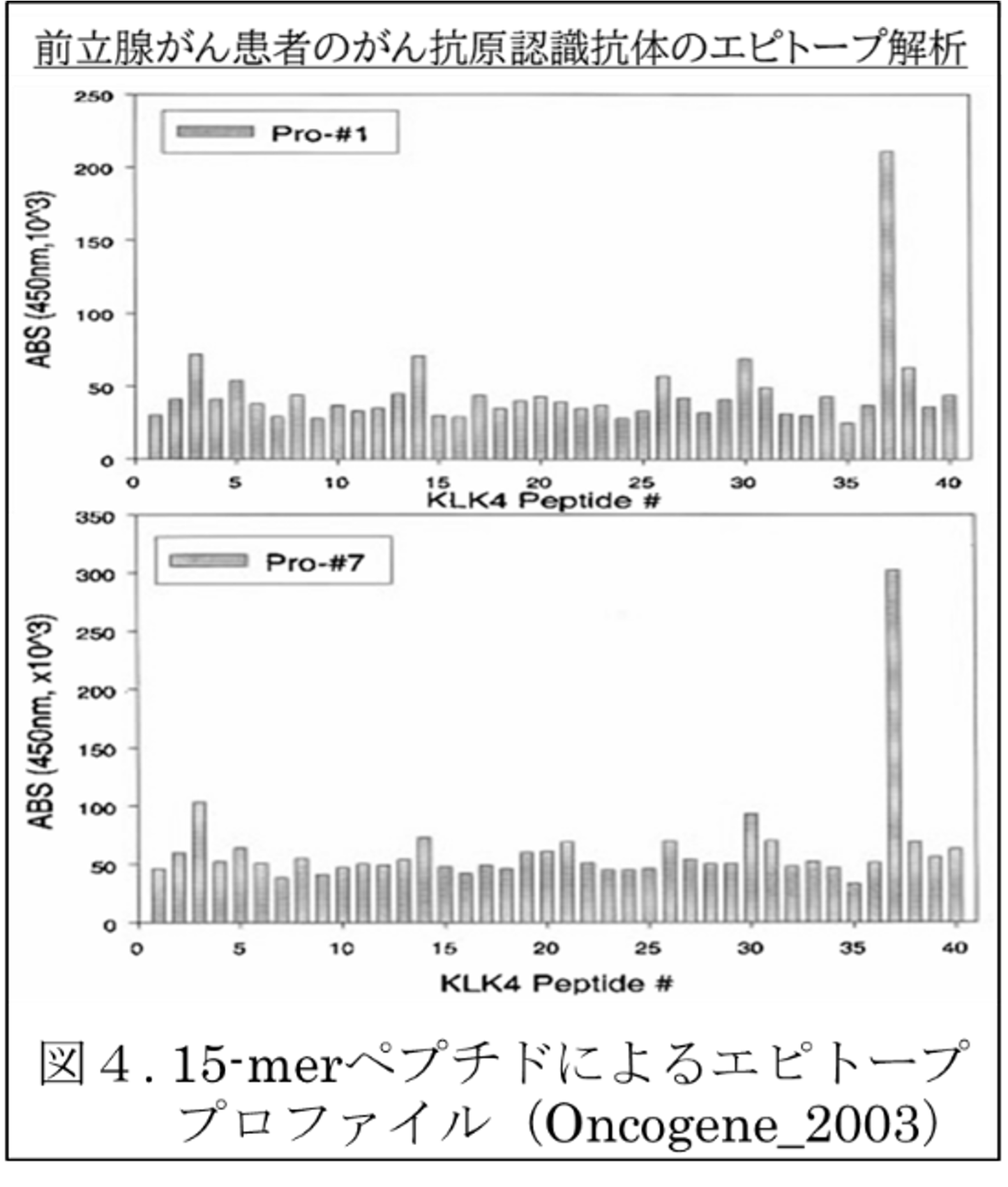
過去のペプチドELISA系は、12-merや15-merペプチドでがん抗原を網羅した「各ペプチド」を強引にELISAプレートにコート(貼り付ける)するものであった。その方法でも、がん抗原ペプチド(エピトープ)特異的抗体をがん患者血清中に、検出できた(右図)。しかし感度が低いことは否めず、また直鎖ペプチドでは立体構造の模倣確率は低いだろうことは、誰の目にも明らかである。この欠点を補い、ペプチドを抗体認識エピトープらしくELISAプレート上に立ち上げる、提示する方法、技術を試みてきた。その一つが“閉鎖環状ペプチド(下段3-3を参照)”の提示であり、また“ビオチン化ペプチド(下段3-2を参照)”の使用である。前者は我々が多用する独自の手法であり、後者は一部のエピトープ研究者には多用されている手法である。最近Luminex法でbiotin-ペプチドのセットを用いて、自己免疫患者の抗体プロファイルをペプチドエピトープのレベルで、網羅的に解析する報告もある。
このエピトープ(ペプチド)レベルの解析の最大の利点は、非特異的シグナルの低下が期待できることである。実験者が何より、自身のデータの信頼性に自信を持ち、研究を積み重ねられることである。またぺプチドエピトープのレベルで検出できる抗体は、すでにそれ自体として“高親和性”である可能性が高く、エピトープの配列ホモロジー検索も活用できる利点もある。このように、抗体のエピトープ認識を、霞のかかった「3D/4Dの立体構造認識」から、より簡潔に表現できる「1次アミノ酸配列、heklix/sheet構造の2次構造」で解析することを、研究遂行のモットーとしてきた。本来蛋白は、アミノ酸の1次配列から3D構造が構築できるとされる。分子サイズが大きくなると、シャペロン分子の助けが必要だが、1次構造、局所の2D構造の積み重ねとして“蛋白”をみていきたい。
3)IgG4抗体関連技術の医療応用
3-1. 治療用IgG4抗体のデザインと作出(AMED免疫アレルギー実用化研究/科研費研究/企業共同研究/JST-SUステップ2)
アレルギー患者血清中のIgE認識エピトープのプロファイリング技術を構築して、個々患者によって、共通するIgEエピトープと個別に異なるIgEエピトープのあることを明確に示した。そのプロファイリング技術と患者のOIT不応答性などの臨床データから、アナフィラキシーにつながるkeyとなる”pathogenic IgE認識エピトープ”を見出すことができる。
さらに、そのようなpathogenic エピトープを認識するIgG4抗体も患者(OIT施行患者)由来の末梢血PBから、組換え抗体として取得できる。
被験者に共通するエピトープと、個々人に特異的なエピトープも検出される結果である。大まかに、かつ詳細にエピトープ特異的抗体の生成を検出し、プロファイリングできる利点がある。その分類分けとプロファイル特徴を把握できる診断キット開発をJST-SUステップ2にて実施中である。現診断法のImmunoCAP-sIgE価の測定を超える利点があり、臨床現場での使用を目指して開発を進めている。
3-2. エピトーププロファイリング技術の診断用途の開発(AMED橋渡し研究/JST-SUステップ2)
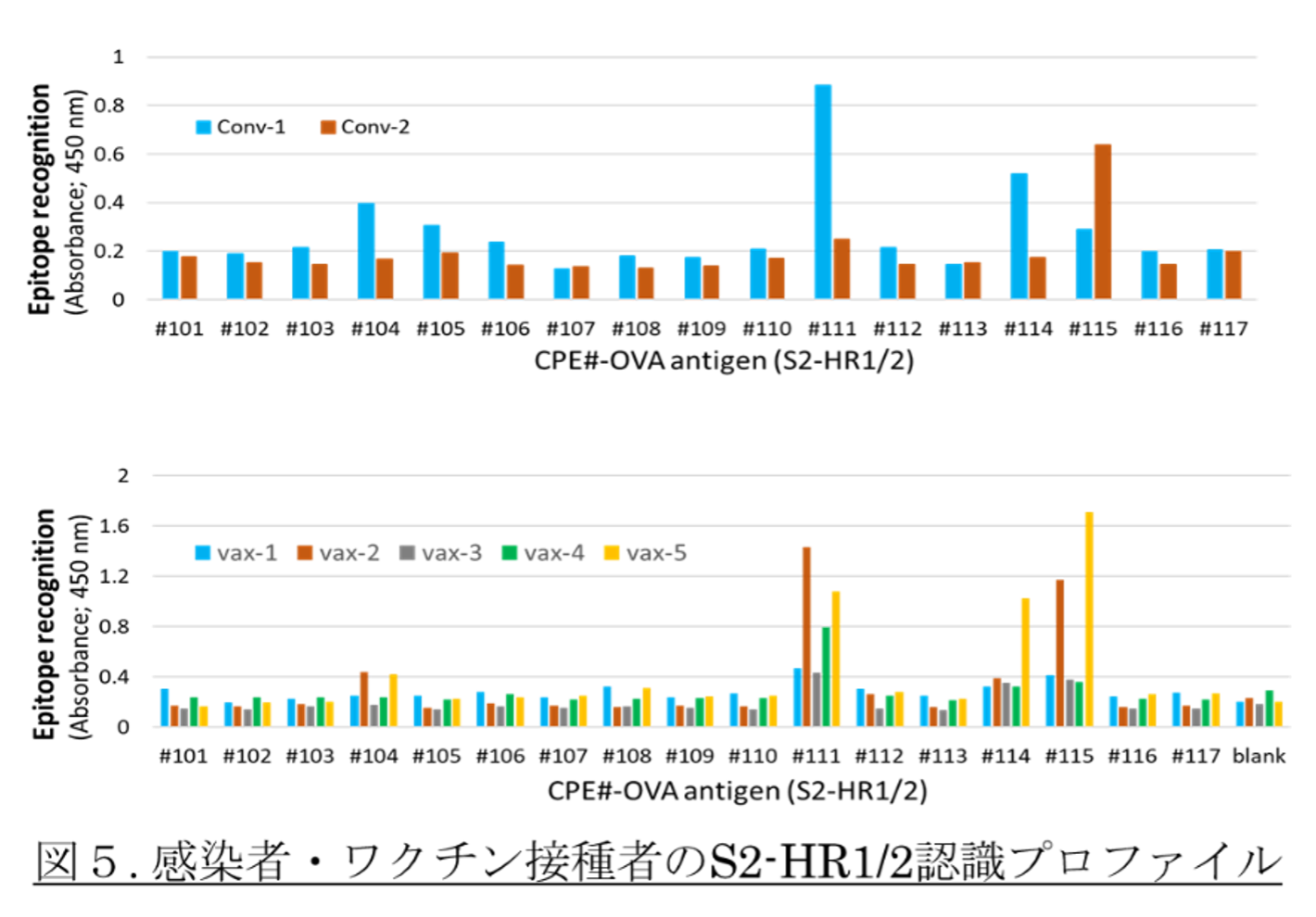
コロナワクチン被験者、感染者の血中抗体のS2-HR1/2部位ペプチドへの反応性を、エピトーププロファイリングした結果を例示する。上記の食物アレルギー患者のプロファイリング結果と同じく共通認識エピトープはあるが、個別に特徴的に認識するエピトープも散見される(下図)。我々が同定した感染中和エピトープ(#111エピトープ)を認識する抗体を保有している被検者もいるが、保有しないワクチン接種者もいるようだ。この違いと、各々被検者層の再感染リスクに関連性があるかもしれない。
疾患対象を広げれば、自己免疫性疾患の重症度がエピトープ認識抗体のプロファイリングの違いに関連するかもしれない。自己抗原反応性抗体の質的違い(エピトープ認識の違い)も、自己抗体の強度(抗体の量)とともに、疾患進行・重症度のバイオマーカーとして数値化されていくのではないかと考え、研究を進めている。先行し開発しているアレルギー診断技術(前項3-1項)を自己免疫疾患標的分子に応用する課題である。
3-3. エピトープ提示ワクチンの開発(AMED-SCARDA)
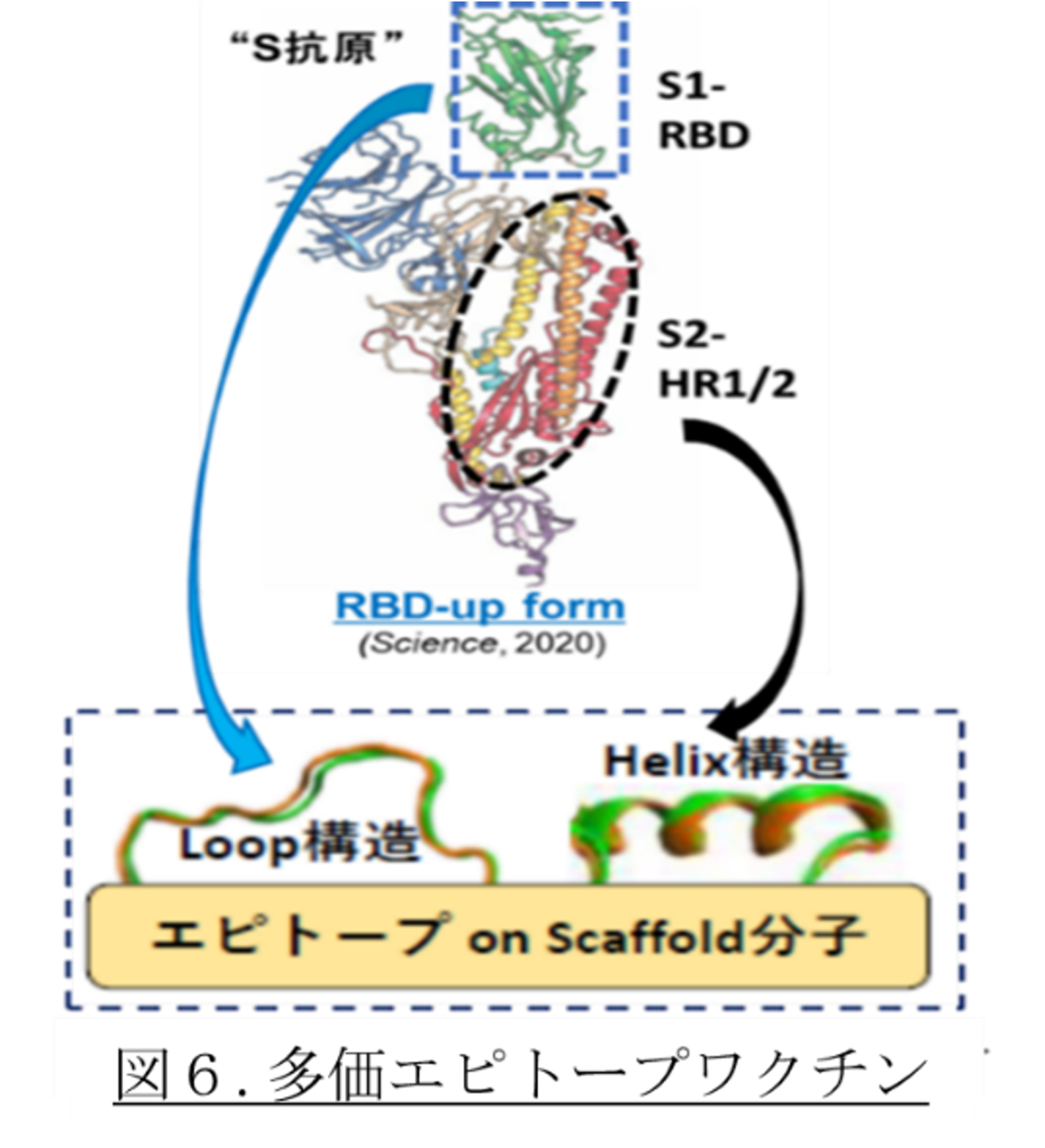
上記のプロファイリング技術を、「中和エピトープ提示合成抗原」の開発に活用している。実際に、RBD部位に2か所の中和エピトープを同定し、S2-HR2領域にpenetration(膜融合)阻害抗体エピトープを1か所同定し、これら3か所エピトープを提示したワクチン抗原(図6)を、新規モダリティーとして開発中である。この研究開発課題は現在、神戸学院大学・国嶋崇隆教授、京都大学・三浦智行准教授、金沢医科大学・川野充弘教授、医療法人北斗会・尾崎史郎会長との共同研究、研究参加を得て進めている。
RBD部位の2エピトープ部位にはOmicron株等variantsにおいて変異の挿入される部位であることが分かり、variants生出に素早く対応した変異配列エピトープを提示するワクチン抗原を作出可能と考えている。また膜融合に関わるS2-HR2領域の中和エピトープ部位は、既知のすべてのvariantsに共通する“universal中和エピトープ”であることが明らかとなっている。舌下ブースターとしての有効性も併せて検討し、次のパンデミックなどに対応する技術として確立したいと考えている。